MENU
三洋化成ニュース No.538
2023.06.05
バイオ・メディカル事業本部 研究部 医薬品研究グループ
ユニットチーフ 太田 浩二
[お問い合わせ先]
バイオ・メディカル事業本部 営業部
近年、高齢化や生活習慣病増大に起因する医療費の高騰、医療人材の逼迫、医療制度改革、さらにはコロナ禍に伴う行動変容などを背景として、医療業界は大きな転換期に直面している。とりわけ健康寿命と生命寿命の差を縮めることは喫緊の課題となっており、疾病の早期発見や再生医療技術の進化へ大きな期待が向けられている。現在、これらの分野で非常に高い注目を集めているのが「細胞外小胞(Extracellular Vesicles、以下、EV)」と呼ばれる物質である。
EVの発見は30年以上前になるが、当時は細胞が不要な物質を捨てるただのゴミ箱と位置付けられ全く注目を集めていなかった。ところが、がんをはじめとするさまざまな病気、組織の修復、免疫応答、老化現象など多様な生命現象への関与が示されるやいなや、わずか十数年で爆発的に研究が加速し、今日では多くの媒体で特集が組まれるほどに注目を集めている。
本稿では、当社がこれまで培ってきた界面制御技術を生かして開発したユニークなEVの精製技術(バイオセパレーション技術)について紹介する。
EVは細胞が分泌する顆粒状の物質で、その表面は細胞膜由来の脂質、タンパク質を含み、内部には核酸(マイクロRNA、メッセンジャーRNA、DNAなど)やタンパク質など細胞内の物質を含んでいる(図1)。その産生経路もしくはサイズによってエクソソーム、マイクロベシクル、アポトーシス小体の3種に分別される。しかし、これらの定義や産生経路の特定は非常に困難であり、しばしば混乱を招いていたため、2011年に設立された国際細胞外小胞学会(International Society for Extracellular Vesicles:ISEV)は一くくりに「Extracellular Vesicles」と呼ぶことを推奨している。本稿でもエクソソームを含む細胞外小胞にEVという名称を使用する。
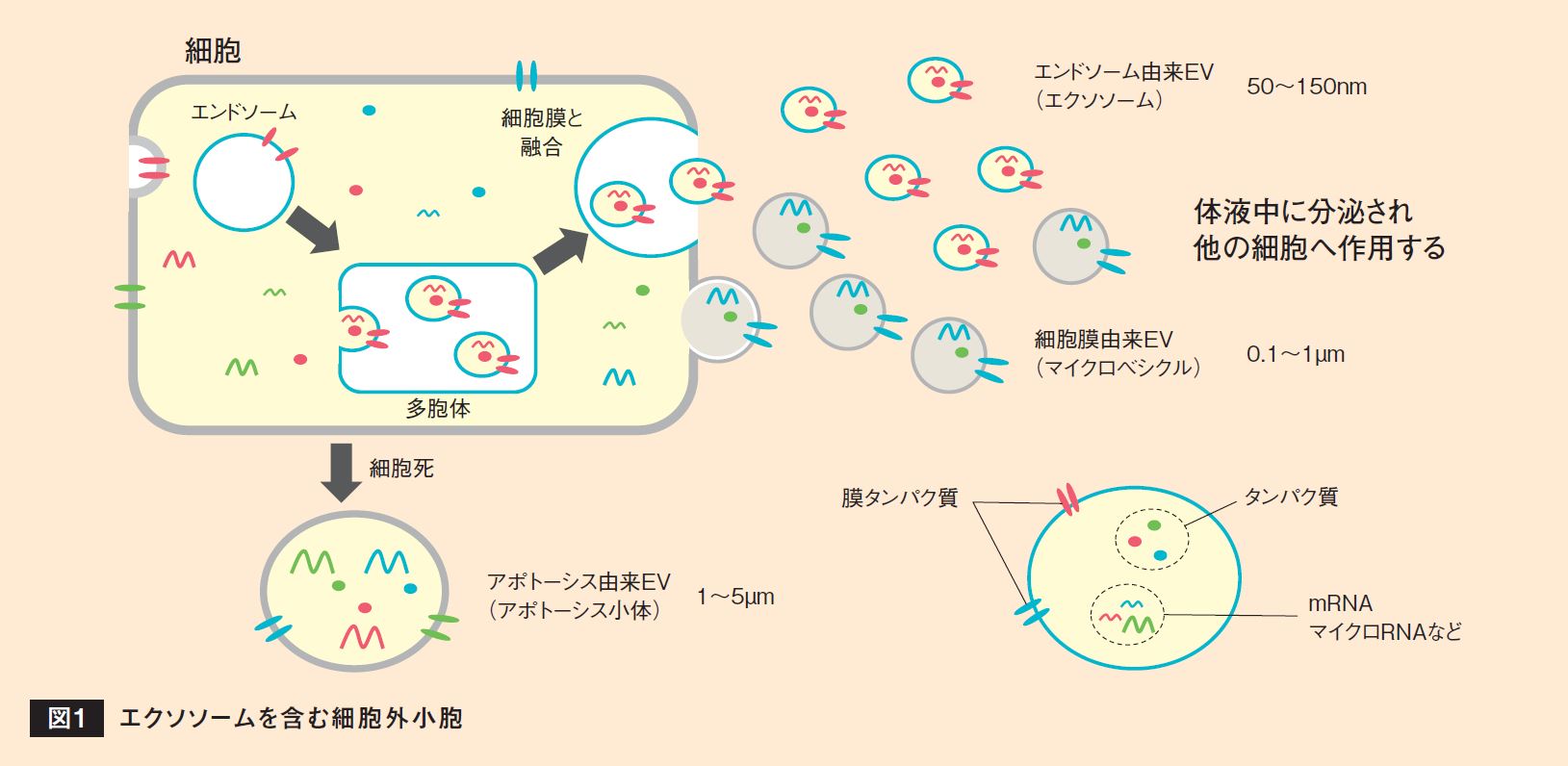
細胞から分泌されたEVは体液(血液、髄液、唾液、尿)に乗って体内を循環し、表面または内部の分子を巧みに利用して細胞間のコミュニケーションを行う役割を担うことがわかっている。
体内を循環しているEVを別の細胞が受け取ると、さまざまな反応を経て、疾病の進行や治療効果に関与する。例えば、がん細胞が放出するEVは、がんの転移促進、免疫細胞の抑制、新生血管の誘導などに働くことが示されている。EVは分泌元の細胞の情報を含んでいることから、体液中のEVを採取して疾病の情報を解析し、超早期に病気を発見する新たな診断法が開発されている(図2)。また、一部の細胞が放出するEVは腎機能の改善や、炎症抑制などの治療効果をもたらすことが報告されており、治療の難しい神経変性疾患であるアルツハイマー型認知症などにも適用が検討されている。
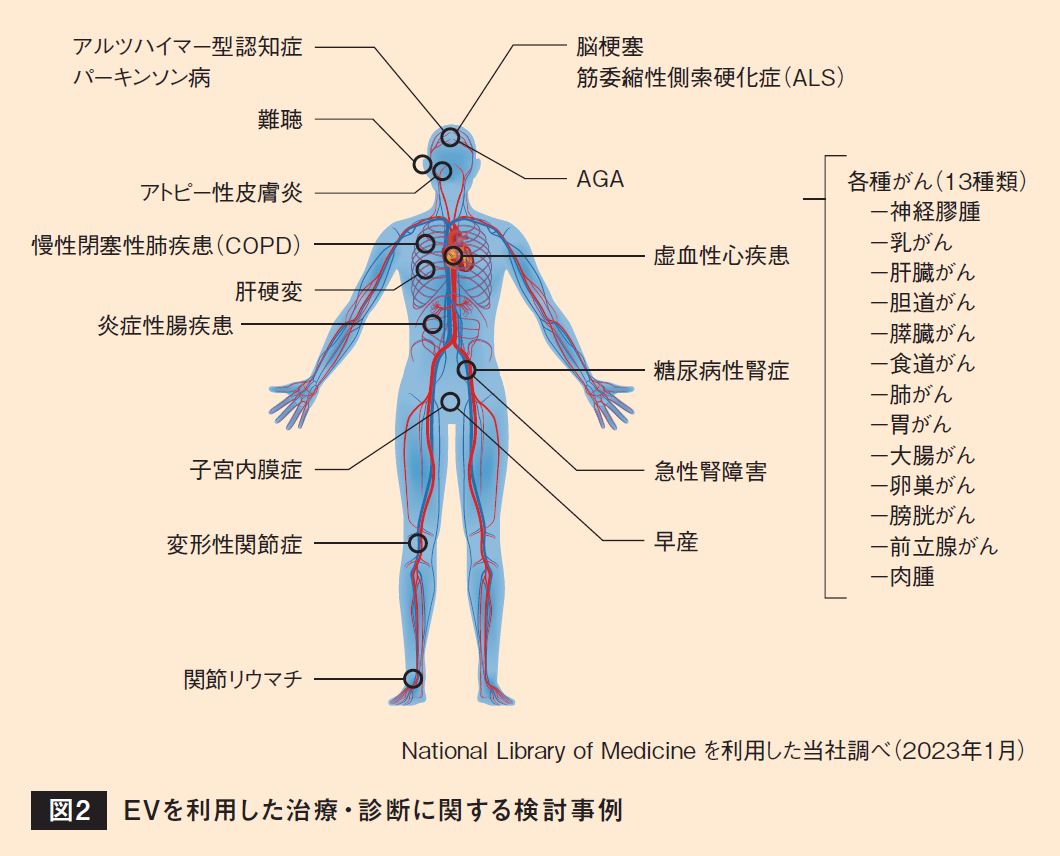
このように国内外のさまざまな研究機関、企業でEVに関する研究が進行しており、医療分野だけでなく、食品や農業などさまざまな分野での可能性も示されている。
一方で、EVを医療現場で利用するためには、適切な投与量設計や副作用の有無などの臨床成績、対応する法律整備、市場に供給可能な生産方法やコストなど、乗り越えなければならない壁がいくつか存在する1)。特に、EVを体液や培養液などから高効率に高精製度で取り出すバイオセパレーション技術は、多くの研究で非常に手技的で煩雑な方法で行われており、たかだか10mL程度をバイオセパレーションするのに数日要するなど、産業応用のボトルネックになっている。
バイオセパレーションは生体由来試料より細胞・タンパク質・核酸などの生体物質を選択的に分離する技術を指し、診断においては疾患の検査感度に直結し、治療においては薬効、副作用に影響する創薬のコアとも呼べる重要技術である。現在、EVのバイオセパレーション方法としては超遠心分離機を利用した手法がゴールドスタンダードとされている。一般的な超遠心分離のイメージは目標物が分離機の底にたまって回収できるイメージであろうが、この方法でEVを高純度で得る場合は、カクテルのように密度勾配をつくった液体中に試料を投入し、遠心分離後の特定の高さに現れる層を吸い出して回収するという非常に繊細な手技が必要になる。この複雑かつ長時間の操作で回収率は20%に満たないというのがEV特有の難しさであり、EVの実用化においてバイオセパレーションが壁といわれるゆえんである。上記の課題解決に対するニーズは大きく、超遠心法に比較して簡易な操作でバイオセパレーションできる研究試薬が上市されているので、大別してまとめた(図3)。

しかしながら、これら製品のほとんどは操作性を改善させる一方で収率や精製度が犠牲になるものも多い。また、アフィニティ法などEV親和性を持たせた固定化担体へEVを吸着させる手法では、精製した後に固定化担体から剝がすために化学試薬を用いるものもあり、創薬を対象とした場合、化学試薬を除去する必要があるなど一長一短であるのが現状である。
当社は、国立大学法人徳島大学大学院医歯薬学研究部保健学域生体機能解析学分野冨永辰也教授、および同大学院社会産業理工学研究部理工学域右手浩一教授らの研究グループと共同で、ハイドロゲルビーズを用いてさまざまな体液からEVを高効率・高収率・高精製度に回収する新規なバイオセパレーション方法『EXORPTIONⓇ法』を開発した。
当社はこれまで尿や血液などの体液を効率よく処理する技術を開発してきた。体外診断用医薬品の事業では夾雑物の多い体液から目的生体分子を取り出すバイオセパレーション用磁気ビーズを製品化し、多くのノウハウを蓄積している。これらの経験と界面制御技術を駆使することで、従来のバイオセパレーション方法の課題を解決するユニークな原理を『EXORPTIONⓇ法』として具現化することに成功した。
『EXORPTIONⓇ法』によるEVの精製について概略を図4に示した。本方法は血液、尿、細胞培養液などの生体由来試料とハイドロゲルビーズを接触させるところから始まる。ビーズは生体由来試料を吸収するよう設計しており、30分程度でビーズが膨潤する。微視的に見るとビーズ表面は網目のようになっており、吸収の過程で液体が網目を抜けてビーズ内に移動することで①低分子夾雑物、②EV、③高分子夾雑物の分離が起こる。低分子夾雑物は網目の中を通り抜けビーズ中に吸収される。EVはビーズ表面がEV親和成分で覆われているため網目に捕捉される。高分子夾雑物はビーズ表面と強く相互作用しないため、次の洗浄工程にて洗い流される。特に高分子夾雑物は検体のpHによって立体構造(コンホメーション)やゼータ電位が変化するため、検体の個体差によって精製度が変化することがあるが、本方法はビーズがバッファー効果を有しており、検体は一定のpHに収束するため、精製度のバラつきが少ない。
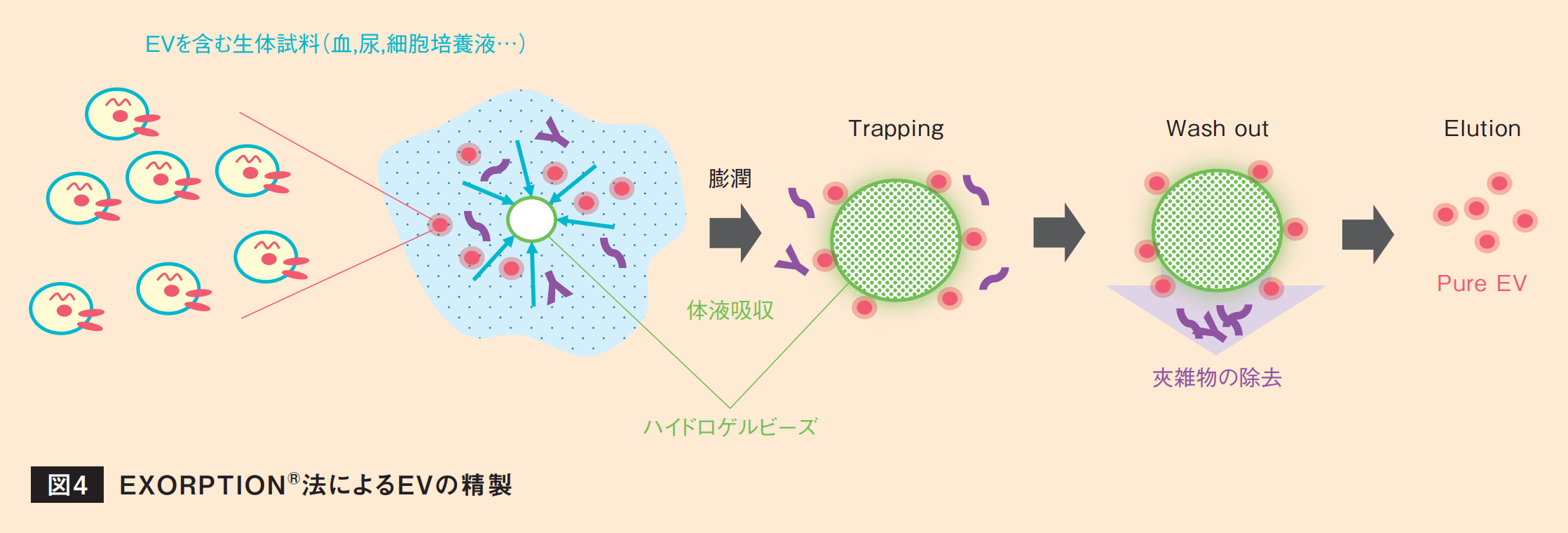
次工程でビーズに吸着したEVを遊離液によって脱離することで最終生成物が得られる。実質ビーズの膨潤とEVの遊離でバイオセパレーションが完了するので、スケールによらず90分という短時間で精製が可能となっている。
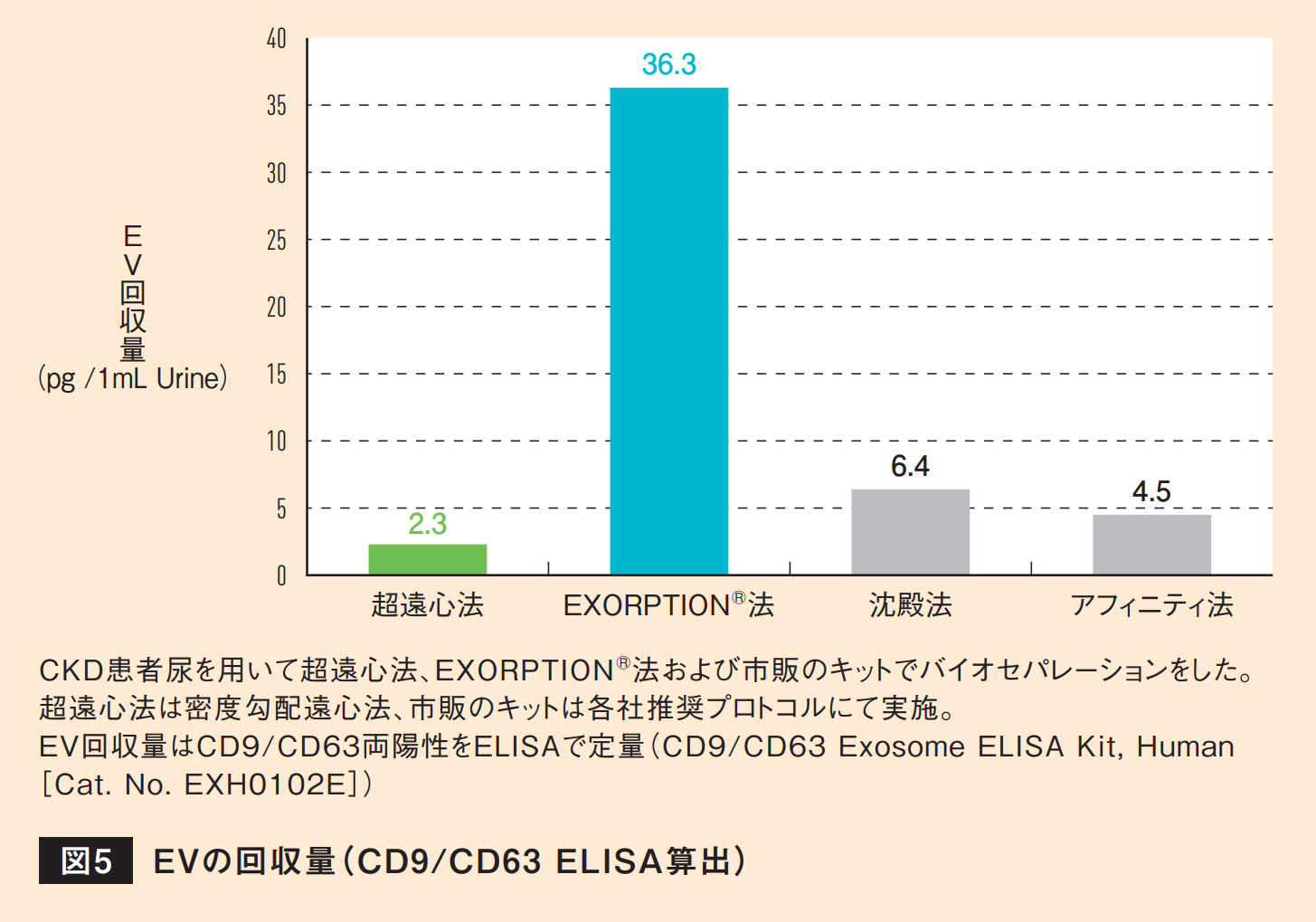
プロセス上の特長は以上になるが、本方法の最大の特長は検体あたりのEV回収量にあり、ゴールドスタンダードの超遠心法と比較して10倍以上の回収率を示す(図5)。この特長は体液中に極微量に含まれるEVを高感度に検出することに貢献するが、それだけでなく、創薬においても治療に用いるEVを大量に得るために有用な技術となる。また、一部のアフィニティ精製法と異なり、最終生成物に試薬由来の化学物質を含まないことやEVの脂質二重膜構造の破壊がない点なども創薬においては大きなメリットとなる。
当社のバイオセパレーション法『EXORPTIONⓇ法』は従来にないユニークな原理を使って、EVの高効率・高回収・高精製を達成しており、EVの社会実装に貢献できる技術と考える。現在、疾病の早期発見や再生医療での実装に向けた開発の主体はアカデミアであり、まずはアカデミアの開発支援のために本技術を研究試薬として実装していく。
本稿で示した通り、EVの研究が進めば、これまでにない画期的な病気の診断・治療法の開発が期待できる。当社は『EXORPTIONⓇ法』を通じてEV研究のさらなる発展に貢献していきたい。
参考文献
1)エクソソームを含む細胞外小胞(EV)を利用した治療用製剤に関する報告書
令和5年1月17日 独立行政法人医薬品医療機器総合機構 科学委員会